Giải hóa 8 bài 17: Bài luyện tập 3
I. Tóm tắt lý thuyết
Phản ứng hóa học, định luật bảo toàn khối lượng
- Quá trình biến đổi chất này thành chât được gọi là phản ứng hóa học.
- Trong phản ứng hóa học số nguyên tử mỗi nguyên tố giữ nguyên trước và sau phản ứng.
- Định luật bảo toàn khối lượng: mA + mB = mC + mD
Phương trình hóa học
- Phương trình hóa học gồm những công thức hóa học của các chất trong phản ứng với hệ số thích hợp sao cho số nguyên tử mỗi nguyên tố ở hai bên đều bằng nhau.
- Để lập phương trình hóa học, ta phải cân bằng hệ số nguyên tử của mỗi nguyên tố (và nhóm nguyên tử, nếu có).
- Từ phương trình hóa học ra rút ra được tỉ lệ số nguyên tử, phân tử giữa các chất trong phản ứng , tỉ lệ này đúng bằng tỉ lệ hệ số trước công thức hóa học.
II. Giải bài tập sgk
Giải câu 1. Hình dưới đây là sơ đồ tượng trưng...
Hình dưới đây là sơ đồ tượng trưng cho phản ứng: giữa khí N2 và khí H2 tạo ra amoniac NH3.
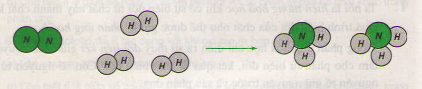
Hãy cho biết
a) Tên các chất tham gia và sản phẩm của phản ứng.
b) Liên kết giữa các nguyên tử thay đổi như thế nào ? Phân tử nào biến đổi, phân tử nào được tạo ra ?
c) Số nguyên tử mỗi nguyên tố trước và sau phản ứng bằng bao nhiêu, có giữ nguyên không ?
Hướng dẫn giải
a)
- Chất tham gia: khí nitơ, khí hiđro
- Sản phẩm: khí amoniac
b) Liên kết giữa 2 nguyên tử nitơ và 2 nguyên tử hi đro bị phá vỡ và hình thành liên kết giữa nguyên tử nitơ và nguyên tử hiđro.
Phân tử hiđro và nitơ bị biến đổi và phân tử amoniac được tạo thành.
c) Số nguyên tử mỗi nguyên tố trước và sau phản ứng vẫn không thay đổi.
Giải câu 2. Khẳng định sau gồm hai ý...
Khẳng định sau gồm hai ý: “ Trong phản ứng hóa học , chỉ phân tử biến đổi còn các nguyên tử giữ nguyên, nên tổng khối lượng các chất phản ứng được bảo toàn’’.
Hãy chọn phương án đúng trong số các phương án sau:
A. Ý 1 đúng, ý 2 sai;
B. Ý 2 đúng, ý 1 sai;
C. Cả 2 ý đều đúng, nhưng ý 1 không giải thích cho ý 2;
D. Cả 2 ý đều đúng, nhưng ý 1 giải thích cho ý 2;
E. Cả 2 ý đều sai.
(Ghi trong vở bài tập)
Hướng dẫn giải
Đáp án D
Cả 2 ý đều đúng, nhưng ý 1 giải thích cho ý 2.
Giải câu 3.Canxi cacbonat (CaCO3)...
Canxi cacbonat (CaCO3) là thành phần chính của đá vôi. Khi nung đá vôi xẩy ra phản ứng hóa học sau:
Canxi cacbonat → Canxi oxit + Canbon đioxit
Biết rằng khi nung 280kg đá vôi tạo ra 140kg canxi CaO (vôi sống) và 110kg khí cacbon đioxit CO2.
a) Viết công thức về khối lượng phản ứng.
b) Tính tỉ lệ phần trăm về khối lượng canxi cacbonat chứa trong đá vôi.
Hướng dẫn giải
a) PTHH: CaCO3 → CO2 + CaO
Theo định luật bảo toàn khối lượng ta có:
mCaCO3 = mCaO + mCO2 (1)
b) Từ phương trình (1) ta có:
mCaCO3 = mCaO + mCO2 = 140 + 110 = 250 kg
=> Phần trăm về khối lượng của canxi cacbonat chứa trong đá vôi là
%CaCO3 = $\frac{250}{280}$.100% = 89,28%.
Giải câu 4. Biết rằng khí etilen...
Biết rằng khí etilen C2H4 cháy là xẩy ra phản ứng với khí oxi O2, sinh ra khí cacbon đioxit CO2 và nước.
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ giữa số phân tử etilen lần lượt với số phân tử oxi và số phần tử cacbon đioxit.
Hướng dẫn giải
a) Sơ đồ phản ứng: C2H4 + O2 ---> CO2 + H2O
PTHH: C2H4 + 3O2 → 2CO2 + 2H2O
b) Tỉ lệ giữa số phân tử etilen lần lượt với số phân tử oxi và số phần tử cacbon đioxit là:
- Số phân tử etilen : số phân tử oxi = 1 : 3
- Số phân tử etilen : số phân tử cacbon đioxit = 1 : 2
Giải câu 5. Cho sơ đồ phản ứng sau...
Cho sơ đồ phản ứng sau:
Al + CuSO4 - - -> Alx(SO4)y + Cu
a) Xác định các chỉ số x và y.
b) Lập phương trình hóa học. Cho biết tỉ lệ số nguyên tử của cặp đơn chất kim loại và tỉ lệ số phân tử của cặp hợp chất.
Hướng dẫn giải
a) Al có hóa trị III, và nhóm SO4 hóa trị II
=>Ta có tỉ lệ : $\frac{x}{y} = \frac{2}{3}$ => x = 2; y = 3
Công thức hóa học: Al2(SO4)3
b) PTHH: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Tỉ lệ nguyên tử của cặp đơn chất kim loại:
- Số nguyên tử Al : số nguyên tử Cu = 2 : 3.
- Số phân tử CuSO4 : số phân tử Al2(SO4)3 = 3 : 1
Xem thêm lời giải Giải môn Hóa học lớp 8
- 👉 Giải hóa 8 bài 2: Chất
- 👉 Giải hóa 8 bài 4: Nguyên tử
- 👉 Giải hóa 8 bài 5: Nguyên tố hóa học
- 👉 Giải hóa 8 bài 6: Đơn chất và hợp chất. Phân tử
- 👉 Giải hóa 8 bài 7: Bài thực hành 2: Sự lan tỏa của chất
- 👉 Giải hóa 8 bài 8: Bài luyện tập 1
- 👉 Giải hóa 8 bài 9: Công thức hóa học
- 👉 Giải hóa 8 bài 10: Hóa trị
- 👉 Giải hóa 8 bài 11: Bài luyện tập 2
- 👉 Giải hóa 8 bài 12: Sự biến đổi chất
- 👉 Giải hóa 8 bài 13: Phản ứng hóa học
- 👉 Giải hóa 8 bài 14: Bài thực hành 3: Dấu hiệu của hiện tượng hóa học và phản ứng hóa học
- 👉 Giải hóa 8 bài 15: Định luật bảo toàn khối lượng
- 👉 Giải hóa 8 bài 16: Phương trình hóa học
- 👉 Giải hóa 8 bài 17: Bài luyện tập 3
- 👉 Giải hóa 8 bài 18: Mol
- 👉 Giải hóa 8 bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- 👉 Giải hóa 8 bài 20: Tỉ khối chất khí
- 👉 Giải hóa 8 bài 21: Tính theo công thức hóa học
- 👉 Giải hóa 8 bài 22: Tính theo phương trình hóa học
- 👉 Giải hóa 8 bài 23: Bài luyện tập 4
- 👉 Giải hóa 8 bài 24: Tính chất của oxi
- 👉 Giải hóa 8 bài 25: Sự oxi hóa. Phản ứng hóa hợp. Ứng dụng của oxi
- 👉 Giải hóa 8 bài 26: Oxit
- 👉 Giải hóa 8 bài 27: Điều chế khí oxi. Phản ứng phân hủy
- 👉 Giải hóa 8 bài 28: Không khí. Sự cháy
- 👉 Giải hóa 8 bài 29: Bài luyện tập 5
- 👉 Giải hóa 8 bài 30: Bài thực hành 4: Điều chế, thu khí và thử tính chất của oxi
- 👉 Giải hóa 8 bài 31: Tính chất, ứng dụng của hiđro
- 👉 Giải hóa 8 bài 32: Phản ứng oxi hóa khử
- 👉 Giải hóa 8 bài 33: Điều chế khí hidro. Phản ứng thế
- 👉 Giải hóa 8 bài 34: Bài luyện tập 6
- 👉 Giải hóa 8 bài 35: Bài thực hành 5
- 👉 Giải hóa 8 bài 36: Nước
- 👉 Giải hóa 8 bài 37: Axit. Bazơ. Muối
Lớp 8 | Các môn học Lớp 8 | Giải bài tập, đề kiểm tra, đề thi Lớp 8 chọn lọc
Danh sách các môn học Lớp 8 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2024 ngắn gọn, chi tiết dễ hiểu.
Bài soạn văn lớp 12 siêu ngắn
Toán Học
- Đề thi, đề kiểm tra Toán lớp 8
- Tài liệu Dạy - học Toán 8
- SBT Toán lớp 8
- Vở bài tập Toán 8
- SGK Toán lớp 8
Vật Lý
Hóa Học
- Đề thi, đề kiểm tra Hóa lớp 8
- Tài liệu Dạy - học Hóa học 8
- SBT Hóa lớp 8
- SGK Hóa lớp 8
- Giải môn Hóa học lớp 8
Ngữ Văn
- Đề thi, đề kiểm tra Văn 8
- SBT Ngữ văn lớp 8
- Tác giả - Tác phẩm văn 8
- Văn mẫu lớp 8
- Vở bài tập Ngữ văn lớp 8
- Soạn văn 8 chi tiết
- Soạn văn 8 ngắn gọn
- Soạn văn 8 siêu ngắn
- Bài soạn văn lớp 8 siêu ngắn
- Bài soạn văn 8
- Bài văn mẫu 8
Lịch Sử
Địa Lý
Sinh Học
- Đề thi, đề kiểm tra Sinh lớp 8
- SBT Sinh lớp 8
- Vở bài tập Sinh học 8
- SGK Sinh lớp 8
- Giải môn Sinh học lớp 8
GDCD
Tin Học
Tiếng Anh
- Đề thi, đề kiểm tra Tiếng Anh 8 mới
- SGK Tiếng Anh lớp 8
- SBT Tiếng Anh lớp 8 mới
- Vở bài tập Tiếng Anh 8
- SGK Tiếng Anh lớp 8 Mới