Giải hóa 8 bài 22: Tính theo phương trình hóa học
I. Tóm tắt lý thuyết
Cách tìm khối lượng, thể tích chất tham gia và sản phẩm:
- Bước 1: Viết phương trình hóa học
- Bước 2: Chuyển khối lượng chất và thể tích chất khí thành số mol chất.
- Bước 3: Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành.
- Bước 4: Chuyển đổi số mol chất thành khối lượng (m = n x M) hoặc thể tích khí ở đktc (V = 22,4 x n)
II. Giải bài tập sgk
Giải câu 1. Sắt tác dụng với axit clohiđric...
Sắt tác dụng với axit clohiđric: Fe + 2HCl → FeCl2 + H2.
Nếu có 2,8 g sắt tham gia phản ứng, em hãy tìm:
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
Hướng dẫn giải
Ta có: nFe = m/M = 2,8/56 = 0,05 mol
a) PTHH: Fe + 2HCl → FeCl2 + H2. (1)
Tỉ lệ : 1 2 1 1
0,05 0,1 0,05
Theo phương trình (1) ta có: nH2 = nFe = 0,05 mol
=>Thể tích khí thu được ở đktc là:
VH2 = 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Theo phương trình (1) ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
=>Khối lượng HCl cần dùng là:
mHCl = M . n = 0,1 . 36,5 = 3,65 g
Giải câu 2. Lưu huỳnh S cháy trong không khí...
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2
a) Viết phương trình hóa học của phản ứng lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh đioxit tham gia phản ứng là 1,6 g. Hãy tìm:
- Thể tích khí lưu huỳnh đioxit sinh ra ở đktc
- Thể tích không khí cần dùng ở đktc. Biết khí oxi chiếm 1/5 thể tích của không khí.
Hướng dẫn giải
a) PTHH: S + O2 → SO2 (1)
Tỉ lệ 1 1 1
b. Ta có nS = m/M = 1,6/32= 0,05 mol
Theo phương trình (1) ta có: nSO2= nS = nO2 = 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2 = 22,4.n = 22,4 . 0,05 = 1,12 lít
=>Thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4.n = 22,4 . 0,05 = 1,12 lít
Do khí oxi chiếm 1/5 thể tích của không khí
=> Vkk = 5VO2 = 5 . 1,12 = 5,6 lít
Giải câu 3. Có phương trình hóa học sau...
Có phương trình hóa học sau:
CaCO3 →(to) CaO + CO2
a) Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 g CaO ?
b) Muốn điều chế được 7 g CaO cần dùng bao nhiêu gam CaCO3 ?
c) Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc) ?
d) Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng?
Hướng dẫn giải
PTHH: CaCO3 →(to) CaO + CO2 (1)
Tỉ lệ : 1 1 1
a) Theo phương trình (1) ta có:
nCaCO3 = nCaO = m/M = 11,2/56 = 0,2 mol
Vậy cần dùng 0,2 mol CaCO3 để điều chế CaO
b) Theo phương trình (1) ta có:
nCaCO3= nCaO = 7/56 = 0,125 mol
=>Khối lượng CaCO3 cần thiết là:
mCaCO3 = M . n = 100 . 0,125 = 12,5 gam
c) Theo phương trình (1) ta có:
nCaCO3 = nCO2 = 3,5 mol
=>Thể tích khí CO2 sinh ra là:
VCO2 = 22,4 . n = 22,4 . 3,5 = 78,4 lít
d) Theo phương trình (1) ta có:
nCaCO3 = nCaO = nCO2= 13,44/22,4= 0,6 mol
Vậy khối lượng các chất:
- mCaCO3 = 0,6 . 100 = 60 gam
- mCaO = 0,6 . 56 = 33,6 gam
Giải câu 4. a) Cacbon oxit CO tác dụng với...
a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học
b) Nếu muốn đốt cháy 20 mol CO thì phải dùng bao nhiêu mol CO2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất ?
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
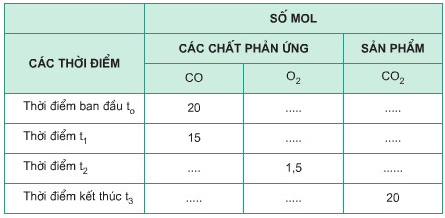
Hướng dẫn giải
a) PTHH: 2CO + O2 →(to) 2CO2
Tỉ lệ : 2 1 2
b) Để thu được một chất khí duy nhất là CO2 thì các chất tham gia phản ứng vừa đủ với nhau. Theo phương trình phản ứng
=>nO2=1/2nCO= ½.20 =10 mol
c) Bảng số mol các chất:
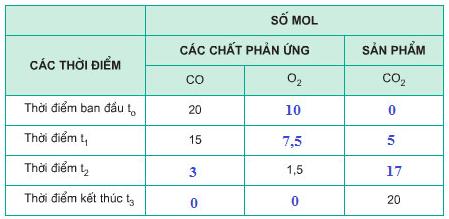
Giải câu 5. Hãy tìm thể tích khí oxi đủ ...
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng:
- Khí A có tỉ lệ khối đối với không khí là 0,552
- Thành phần theo khối lượng của khí A là: 75% C và 25% H
Các thể tích khí đo ở đktc.
Hướng dẫn giải
Khí A có tỉ khối với không khí là 0,552 (dA/kk = 0,552)
=> MA = 29 . 0,552 = 16 g
Trong 1 mol khí A có:
mC = 16.75% = 12 (g) => nC = 12/12 = 1 mol
mH = 16.25% = 4 (g) => nH = 4/1 = 4 mol
Vậy công thức hóa học của khí A là CH4
PTHH: CH4 + 2O2 → CO2 + 2H2O
Tỉ lệ 1 2 1 2
nCH4 = 11,2/22,4 = 0,5 mol
Theo phương trình phản ứng nO2 = 2nCH4 = 2.0,5 = 1 mol
Thể tích khí O2 cần là : VO2 = 1.22,4 = 22,4 (lít)
Xem thêm lời giải Giải môn Hóa học lớp 8
- 👉 Giải hóa 8 bài 2: Chất
- 👉 Giải hóa 8 bài 4: Nguyên tử
- 👉 Giải hóa 8 bài 5: Nguyên tố hóa học
- 👉 Giải hóa 8 bài 6: Đơn chất và hợp chất. Phân tử
- 👉 Giải hóa 8 bài 7: Bài thực hành 2: Sự lan tỏa của chất
- 👉 Giải hóa 8 bài 8: Bài luyện tập 1
- 👉 Giải hóa 8 bài 9: Công thức hóa học
- 👉 Giải hóa 8 bài 10: Hóa trị
- 👉 Giải hóa 8 bài 11: Bài luyện tập 2
- 👉 Giải hóa 8 bài 12: Sự biến đổi chất
- 👉 Giải hóa 8 bài 13: Phản ứng hóa học
- 👉 Giải hóa 8 bài 14: Bài thực hành 3: Dấu hiệu của hiện tượng hóa học và phản ứng hóa học
- 👉 Giải hóa 8 bài 15: Định luật bảo toàn khối lượng
- 👉 Giải hóa 8 bài 16: Phương trình hóa học
- 👉 Giải hóa 8 bài 17: Bài luyện tập 3
- 👉 Giải hóa 8 bài 18: Mol
- 👉 Giải hóa 8 bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
- 👉 Giải hóa 8 bài 20: Tỉ khối chất khí
- 👉 Giải hóa 8 bài 21: Tính theo công thức hóa học
- 👉 Giải hóa 8 bài 22: Tính theo phương trình hóa học
- 👉 Giải hóa 8 bài 23: Bài luyện tập 4
- 👉 Giải hóa 8 bài 24: Tính chất của oxi
- 👉 Giải hóa 8 bài 25: Sự oxi hóa. Phản ứng hóa hợp. Ứng dụng của oxi
- 👉 Giải hóa 8 bài 26: Oxit
- 👉 Giải hóa 8 bài 27: Điều chế khí oxi. Phản ứng phân hủy
- 👉 Giải hóa 8 bài 28: Không khí. Sự cháy
- 👉 Giải hóa 8 bài 29: Bài luyện tập 5
- 👉 Giải hóa 8 bài 30: Bài thực hành 4: Điều chế, thu khí và thử tính chất của oxi
- 👉 Giải hóa 8 bài 31: Tính chất, ứng dụng của hiđro
- 👉 Giải hóa 8 bài 32: Phản ứng oxi hóa khử
- 👉 Giải hóa 8 bài 33: Điều chế khí hidro. Phản ứng thế
- 👉 Giải hóa 8 bài 34: Bài luyện tập 6
- 👉 Giải hóa 8 bài 35: Bài thực hành 5
- 👉 Giải hóa 8 bài 36: Nước
- 👉 Giải hóa 8 bài 37: Axit. Bazơ. Muối
Lớp 8 | Các môn học Lớp 8 | Giải bài tập, đề kiểm tra, đề thi Lớp 8 chọn lọc
Danh sách các môn học Lớp 8 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2024 ngắn gọn, chi tiết dễ hiểu.
Bài soạn văn lớp 12 siêu ngắn
Toán Học
- Đề thi, đề kiểm tra Toán lớp 8
- Tài liệu Dạy - học Toán 8
- SBT Toán lớp 8
- Vở bài tập Toán 8
- SGK Toán lớp 8
Vật Lý
Hóa Học
- Đề thi, đề kiểm tra Hóa lớp 8
- Tài liệu Dạy - học Hóa học 8
- SBT Hóa lớp 8
- SGK Hóa lớp 8
- Giải môn Hóa học lớp 8
Ngữ Văn
- Đề thi, đề kiểm tra Văn 8
- SBT Ngữ văn lớp 8
- Tác giả - Tác phẩm văn 8
- Văn mẫu lớp 8
- Vở bài tập Ngữ văn lớp 8
- Soạn văn 8 chi tiết
- Soạn văn 8 ngắn gọn
- Soạn văn 8 siêu ngắn
- Bài soạn văn lớp 8 siêu ngắn
- Bài soạn văn 8
- Bài văn mẫu 8
Lịch Sử
Địa Lý
Sinh Học
- Đề thi, đề kiểm tra Sinh lớp 8
- SBT Sinh lớp 8
- Vở bài tập Sinh học 8
- SGK Sinh lớp 8
- Giải môn Sinh học lớp 8
GDCD
Tin Học
Tiếng Anh
- Đề thi, đề kiểm tra Tiếng Anh 8 mới
- SGK Tiếng Anh lớp 8
- SBT Tiếng Anh lớp 8 mới
- Vở bài tập Tiếng Anh 8
- SGK Tiếng Anh lớp 8 Mới